根据NMPA在2025年1月23日发布的《国家药监局关于扩大药品电子通用技术文档实施范围的公告(2025年第10号)》,自2025年1月27日起,药品电子通用技术文档(eCTD)的实施范围进一步扩大。
具体调整如下:
1.化学药品:
● 化学药品1类至5类的药物临床试验申请;
● 化学药品2类、3类、4类、5.2类的上市许可申请
2. 生物制品:
● 预防用生物制品和治疗用生物制品1类至3类的药物临床试验申请;
● 预防用生物制品和治疗用生物制品2类和3类的上市许可申请
此次调整是在2021年12月29日发布的《国家药监局关于实施药品电子通用技术文档申报的公告》(2021年第119号)的基础上进行的,进一步扩大了eCTD的适用范围。申请人需按照现行的eCTD技术文件要求准备和提交电子申报资料,并鼓励通过网络传输方式提交。
从2021年化学药品1类和5.1类、治疗用生物制品1类和预防用生物制品1类的上市许可申请,到如今涵盖更多类别的临床试验申请和上市许可申请,中国eCTD的实施进程显著加快。相比之下,欧美从接收eCTD格式到全面实施基本经历了15年。
为了更好地适应eCTD的实施,相关企业需要提前做好准备,包括熟悉eCTD的技术要求和操作流程。eCTD与传统电子申报在技术规范、文件结构和提交方式等方面仍存在差异,企业需进一步学习和适应,因此笔者特意对eCTD和电子申报制作软件实施的电子申报进行了对比
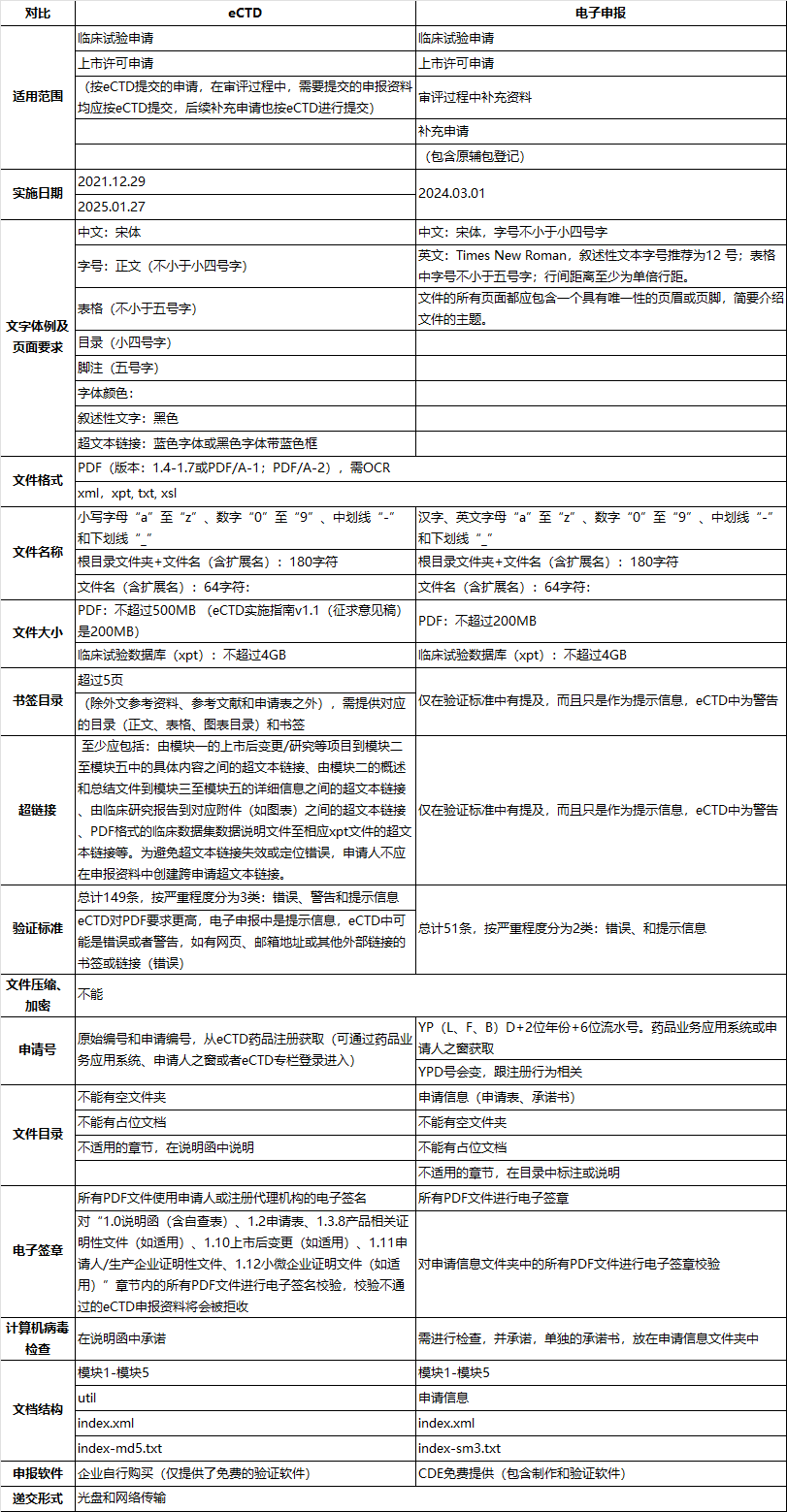
具体对比信息,博主进一步整理了注册圈的表格,放在下载链接,地址:https://pan.quark.cn/s/7caf0ac107fb
本文转自注册圈

